病历介绍:
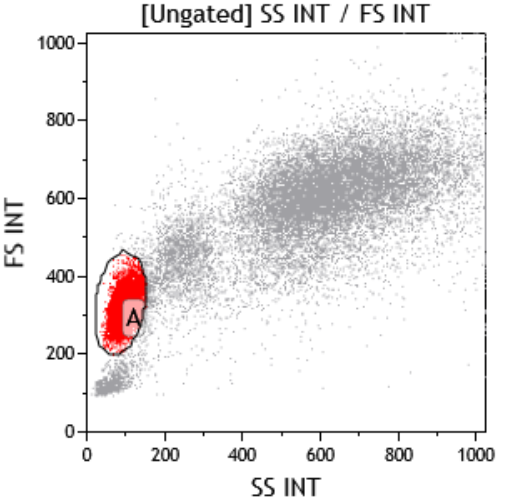
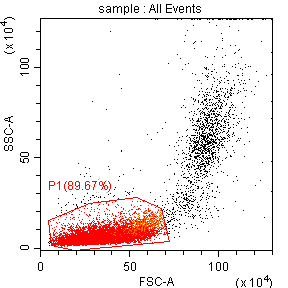
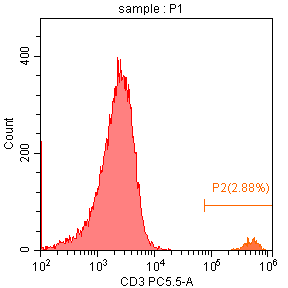
某高校一课题组涉及到人类样本,由于是第一次做关于人源样本,经查询资料得知外周血溶血后在FSC/SSC散点图上会出现淋巴细胞/单核细胞/粒细胞三群(图一),所以设计了健康人CD4/CD3双色实验来研究淋巴细胞预实验,但是在检测时却发现自己的结果与资料上的并不一样,淋巴细胞的群体特别大,而单核和粒细胞以及淋巴细胞中CD3+T淋巴细胞比例也不正常(图二),所以特来问诊,看问题出在哪里,应该如何改善?
小贝问诊答疑:
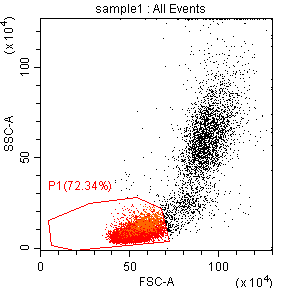
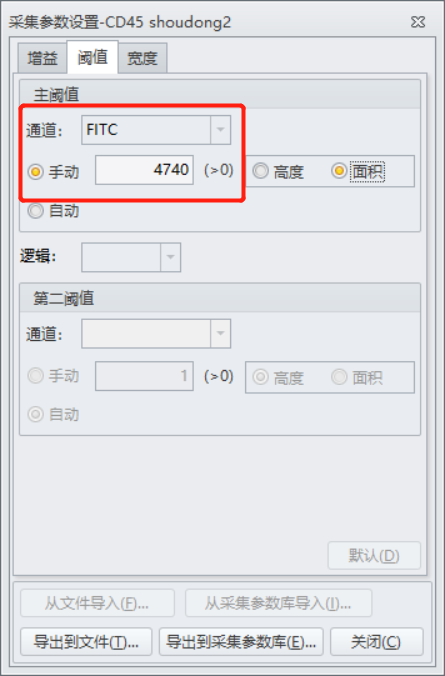
从图二结果来看,粒细胞和单核细胞群体已经出现,但是淋巴细胞群体却与一些碎片类非淋巴群体混杂在一起,并没有完整的分离出来,经过咨询后得知,仪器质控通过,状态稳定,但是样品在制备过程中,溶血效果并不好,还有大量的红细胞存在,所以在图二中P1门控圈定的并不是淋巴细胞群体,而是淋巴细胞与未溶血的红细胞以及碎片混杂在一起。正常情况下,仪器会通过自动阈值来切除多余的碎片信息,但是在样本质量不太好,比如这次的溶血不充分时,自动阈值时仪器并不能区分出目的信号与碎片,导致大量碎片信息出现,而本次实验设置正是使用了仪器的自动阈值(FSC)设置。(图四)
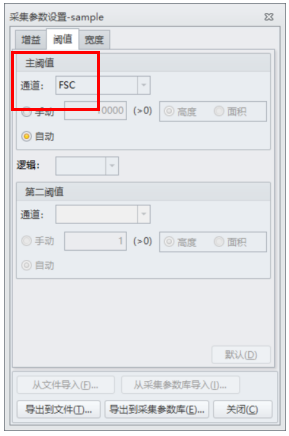
图四
小贝处方:
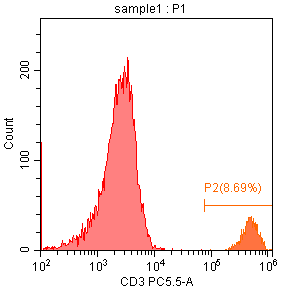
1) 从以上分析,我们推荐在本次检测中,由自动阈值设置改为手动设置,发现通过手动切阈值后,碎片减少(图五),圈定的P1门里CD3+T淋巴细胞比例上升(2.89%到8.69%)(图六),但是仍不是理想结果;
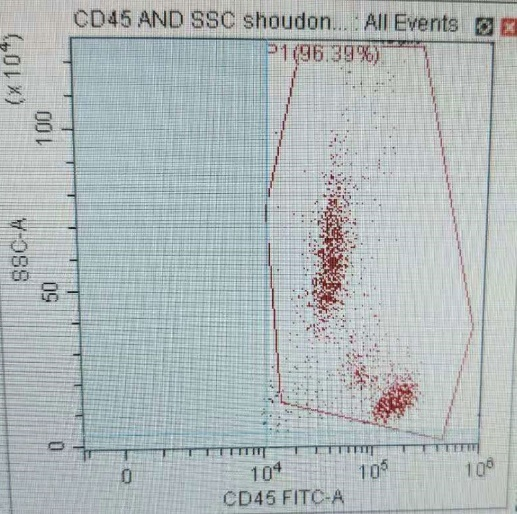
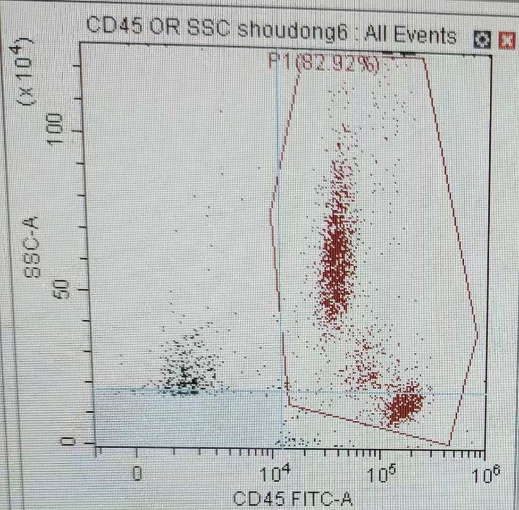
2) 由于白细胞都是CD45+细胞,可以与非白细胞(红细胞)明显区分出来,而且淋单粒三群细胞CD45表达强度存在差异,所以建议在后续实验设计时加染CD45抗体,这样可以利用CD45/SSC来分析圈定淋巴细胞群体,保证结果的准确性(图七);
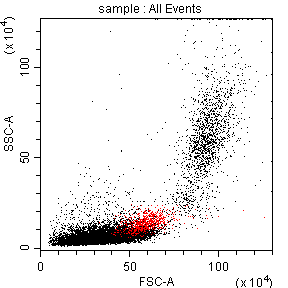

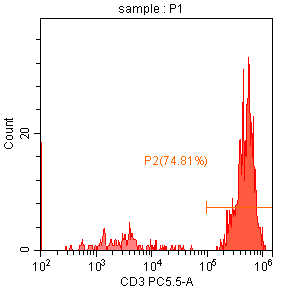
图7
3) 即使加染CD45抗体,可以保证分析结果的准确性,但是如果还是以FSC切阈值仍是有大量碎片存在,影响分析结果的美观以及增加收样时间,我们可以由FSC改为CD45通道来切阈值,这样既可以保证完整的CD45+白细胞群体完整,又只有少量的碎片存在(图八)。
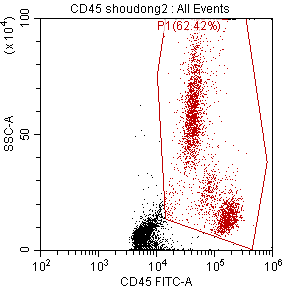
图八
小贝福利:
CytoFLEX不仅可以单通道设置阈值,还可以双通道设置,提供and和or两种不同的双通道阈值设置,它们的区别是“and”的逻辑是两个通道的合并区,蓝色阴影区域的信号不采集;“or”的逻辑是两个通道的重叠区。可以根据需要来选择合适的阈值设置。
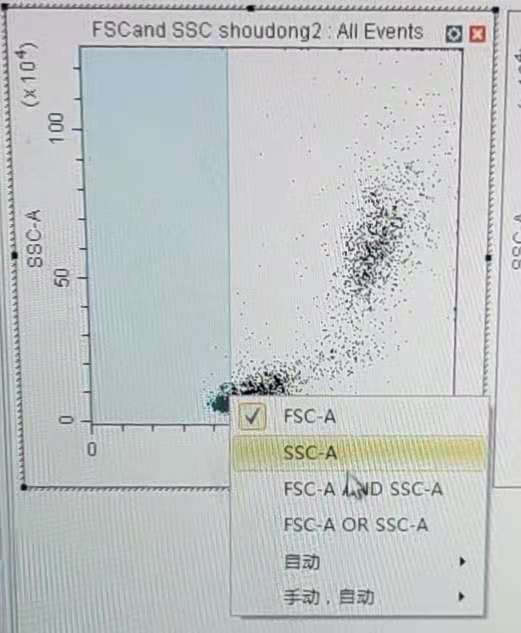
在数据采集过程种,点击 A 阈值设置按钮后,鼠标放置与要设置阈值的散点图上直接设置单通道(主阈值),或者点击右键出现阈值通道与逻辑选择对话框进行选择。或者在采集参数设置中的阈值板块进行设置。
双通道阈值设置时,“and”逻辑展示:两个通道阈值的合并区,浅蓝色阴影区域信号都不采集。
思维发散区:
提问:流式单标管的作用是为了调节补偿,那单标管的制备有什么注意事项,必须是样本加所染抗体吗?
大家可以根据自己所学流式知识思考一下,欢迎大家填表问答,我们将送出“磁性计时器“,答案下期公布。