合成生物学是一门在学术界及工业应用领域都颇具影响力的交叉科学。它包括开发新治疗药物和疫苗、研究植物科学和生物燃料,以及其他许多涉及到将工程学原理应用到生物学中的化学合成制造。其工作重点通常集中在产生天然生物系统的某些部分,对其进行表征分析和分离,然后将其用作工程化生物系统的组件。因此,利用合理的设计准则来设计和组装生物学组件是合成生物学的重要标志。将组装而成的合成DNA构建物引入细胞所导致的结果往往难以预测。这使得测试这些排列组合来筛选理想结果的过程变得尤为重要,这就需要测试多种不同的基因排列来获得想要的结果。现在的常规做法,是将一个个功能基因定义为基因元件,通过合成一个个基因元件,并进行组装,获得更多种类的潜在基因组成。DNA组装实验的完成,是使用NEB公司开发的NEBuilder HiFi DNA组装克隆试剂盒,采用具有15到30个碱基对的终端序列标识的输入DNA, 并通过使用专有的5'核酸外切酶生成突出端。随后在退火时用DNA聚合酶填充互补的3'突出端。DNA连接酶用于最终产物的组装。
整个反应在50°C的温度下孵育15分钟,推荐体积为20μL。
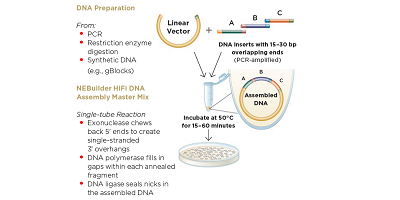
图1: NEBuilder HiFi 试剂盒工作流。经New England Biolabs公司许可,复制自www.neb.com(2018)。
实际的实验过程,需要通过合成一个个基因元件,并进行组装,获得更多种类的潜在基因组成。可想而知,这需要非常大的工作量,为了能更快速的得到结果,整体缩短开发周期,DNA组装过程的自动化必不可少。Echo纳升级移液器能够提供微量化的多种组装化学方案。
我们利用Labcyte Echo® 525 移液器结合NEBuilder® HiFi试剂盒成功实现了五个模块化片段的致癌基因质粒组装(图2)。磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基 α(PIK3CA)是人类肿瘤中的基因,该基因的特定结构域的突变与多种肿瘤类型相关。基于PIK3CA在肿瘤学中的重要性,选择它来证明Echo 525系统驱动的NEBuilder HiFi试剂盒小型化的实际应用。

图2:基于Kpnl-HF酶切pcDNA?3.1/Zeo(+)骨架构建的带有GFP标签的PIK3CA质粒。按次序排列的gBIock片段和载体以蓝色显示,其重叠区域由浅绿色注释标记。PIK3CA基因为黄色,其中对接头(紫色)和turboGFP标签(绿色)进行了注释。图中还显示了pcDNA?3.1/Zeo(+)质粒的其他重要组件。
|
为更真实地模拟实际应用中面临的挑战,我们对该微量化反应体积的模块化DNA组装进行了构建设计。选择PIK3CA癌基因,并根据结构域将其分为四个片段。这些片段或为野生型序列或含有已知致癌突变R38H、E542K、E545K和H1047R。这些片段将被插入线性化的pcDNA?3.1/Zeo (+)哺乳细胞载体中。该Kpnl-HF酶切的载体被称为片段5。所有片段从IDT公司定制(gBIocks®基因片段),其末端均带有23-25个碱基对的重叠区。随后,PCR扩增载体和gBIocks,以获得实验所需材料用量。将经过合成和验证后的DNA转移至经Echo验证过的低死体积384微孔板(384 LDV Plus)。另外将NEBuilder HiFi 2x Master Mix分装入384 LDV Plus板。对于复杂组装,NEBuilder HiFi试剂盒的建议组装体积为20 uL,每个片段的加入量为0.5 pmol。根据以往Echo结果,500 nL反应体系(每个片段1.25 fmol)具有高稳定性。按照该条件完成体系构建和封膜后,于Applied Biosystems ProFlex PCR 50°C孵育1小时。待PCR反应板冷却至4°C后转化到NEB 10B大肠杆菌细胞中。
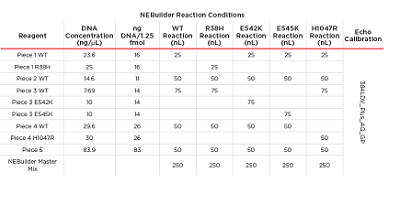
表1:模块化 DNA 组装所使用的试剂体积。这些试剂全部通过Echo 525移液器从 384 LDV Plus 板上进行分滴。
将转化的大肠杆菌手工转移至384孔LDV Plus板中轻轻混匀使用Echo将25 nL /构建质粒转化物以8列方式排列在OmniTrays上(图3)。每个反应通过25nL pUC19对照菌珠隔开。将培养板倒扣,于37°C条件下过夜培养。随后通过菌落qPCR和NGS对单克隆菌落进行确认。

图3:使用Echo 525移液器将大肠杆菌转化物点种在含100 ug/mL 羧苄青霉素、60ug/ml X-Gal和0.1mM IPTG 的LB Agar OmniTray培养板上。每个反应均通过 pUC19 对照菌株(蓝色)隔开。pUC19转化菌包含一个完整的β-半乳糖苷酶通路,其暴露于IPTG和X-Gal 时会变为蓝色。鉴于此,点与点之间的任何交叉污染均能被看见。从左至右,转化反应依次为:WT、R38H、E542K、E545K和H1047R。
这些单克隆菌落被转移到4个装有10 mL LB+Carb100培养基的96孔深孔培养板中进行放大。每个菌落均接种两个重孔(2 mL培养基/菌落),并在37°C条件下摇振过夜培养。次日,将复孔细胞培养物合并,并采用Macherey-Nagel NucleoSpin® 96质粒试剂盒抽提质粒。二次水稀释质粒DNA后,转移50 uL于Echo qualified 384孔pp板内。随后,使用Echo微量化的Quant-iT? Picogreen® dsDNA检测试剂盒方案定量质粒浓度。根据以上定量结果,对质量DNA进行归一化(0.1 ng/每个tagmentation反应)。后续采用基于Echo移液的微量化Nextera XT质粒Tagmentation和加测序接头反应,于Illumina MiSeq平台高通量测序(2x75bp)。将MiSeq生成的FASTQ文件与未突变的PIK3CA进行序列比对(Geneious® 11.0软件)。结果表明,五种目标组装物均成功组装。

表2:Nextera XT质粒Tagmentation和加测序接头反应

图4:将MiSeq 测序数据与未突变的 PIK3CA 进行序列比对。测序覆盖度和突变位置位于每组序列比对的顶部。每组放大区域详细展示了相应的突变氨基酸残基。
本实验的主要目标是微量化500 nL反应体系的同时根据目标突变数目改变模块化组件片段的数目。与试剂盒建议的体积相比,NEBuilder HiFi反应体积被缩减了40倍(从20uL至500 nL)。每个组件片段用量从50 nmoles大幅度降低至1.25 fmol。制备大量的高质量DNA组件极具挑战,而减少所需的DNA分子数则可大幅增加可完成的模块化组装数量。在此,我们利用Labcyte Echo® 525移液器成功在微量体积构建了含有四个致癌基因突变R38H、E542K、E545K和H1047R的PIK3CA及野生型质粒,并采用菌落qPCR和高通量测序对正确组装的菌落进行鉴定和验证。实验表明,纳升级声波移液Echo可大规模增加DNA模块化组装实验通量,优化工作流,同时降低反应成本和DNA原料片段的需求。
本实验中涉及的其他几项工艺改进也为较大规模的DNA模块化组装助力。例如以声波方式将转化细胞涂布在固体培养基上的工艺方式,相比于传统的转化铺板,使用Echo 525移液器进行的OmniTray铺板可节省操作员的时间和培养箱空间。另一方面,琼脂培养板固有的凹坑和不均一的高度使得传统基于枪头的移液技术很难实现均匀铺板;但Echo 525移液器以其独特的定位技术,能够将25 nL体积的细胞悬液非常精准地转移至固体培养基的X、Y网格中。声波无接触式移液,使其具有一个缓冲的Z高度。这允许在最小化培养基高度影响的情况下,将细胞转移至固体培养基上。
使用微量化Nextera XT方案结合Illumina MiSeq,以经济高效的方式,对符合要求的质粒进行高通量测序。以往的研究已证实,Echo525移液器能够将 Nextera
XT 试剂盒反应体系微缩10-100倍。本实验中,我们证实缩小10倍的Nextera XT反应体系也可成功进行质粒验证。采用Echo 525移液器声波移液能使用户前瞻性地减少NGS质粒验证的总体试剂需求,还可大幅改善DNA组装构建工作流更好地为研究、生产服务。
综上所示,贝克曼库尔特Echo 525纳升级移液器能够以低成本的工作流获得高质量的人工合成DNA构建物,极大扩展了基于工程设计的高通量测试,将为科学家探索更广泛的生物学领域助力。
*本文涉及的内容与产品仅用于科研和工业,不用于临床诊断。