也许看到TXTL是,你会一头雾水,这是什么意思呢?TXTL是由两个单词缩写而来,基因的转录Transcription(TX)和翻译Translation(TL)。TXTL又称为无细胞转录-翻译系统,是合成生物学中用于生产重组蛋白的多功能平台,在从蛋白质工程到用于高通量筛选应用的合成生物学的许多科学领域中都广受欢迎。一般而言,TXTL
主要过程是将核苷酸模板添加到包含
TXTL 机制和基本结构单元的体外试剂混合物中,通过该混合物将
DNA 转录成 RNA,并将 RNA 翻译成其编码的蛋白质。下图展示了Arbor
Biosciences的myTXTL®
体外蛋白表达系统工作流程。该系统基于大肠杆菌细胞质提取物,以质粒或线性DNA为模板,依靠内源性核心RNA聚合酶和转录因子sigma
70(μ70),以及有效的能量再生系统,在几分钟内,可以从基因得到可以直接应用于功能分析的蛋白产物。
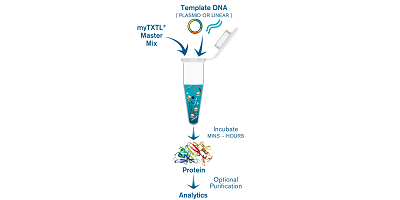
图 1:使用 myTXTL 进行体外蛋白质生产的典型工作流程
与传统的体内基因表达相比,TXTL
具有多种优势。首先由于可以完全忽略细胞活力,将不再产生有毒蛋白质。此外,由于体外系统的开放反应设置,辅助因子(酶工程)、去污剂和膜形成支持试剂(膜蛋白生产)等外源物质的添加变得特别容易。最后,完成设计-构建-测试周期的时间大大缩短,将基于细胞的测定数天的反应,缩短为仅仅数小时,成本降低并显着增加样本量。本文中,我们将展示 myTXTL 与 Echo 525纳升移液器结合,为需要在低成本检测中进行快速高通量处理、灵活性和重现性的基因表达项目提供全面的解决方案。 本实验使用 Echo 525的 25nl精准移液精度,以减少三倍的体积优化 myTXTL 系统内的不同基因表达系统。
作为由内源性大肠杆菌
TXTL 机制控制的基因表达的一个例子,编码增强型绿色荧光蛋白的工程版本的质粒
P70a-deGFP 被滴定到
myTXTL的Master
Mix 中,用纯化的
deGFP 制备的标准曲线对
TXTL 中产生的
deGFP 进行量化。

TABLE 1: 以
P70a-deGFP 为模板建立 4 μL的myTXTL 反应的纳升传输方案。将试剂从
Echo 384 孔聚丙烯 2.0
Plus 微孔板转移到不透明的
Greiner 384 孔检测板中。所有反应四次重复,在BMG
Labtech PHERAstar FS 酶标仪上读取荧光数据制作标准曲线如下图,平均CV为4.05%。

图2:4 μL 体积的
deGFP 标准曲线
在 myTXTL
中,来自 T7 启动子系统的基因表达需要外源添加
T7 RNA 聚合酶。为了将
deGFP 生产与 T7
RNA 聚合酶生产分离,我们决定在
T7 RNA 聚合酶控制的质粒
(T7p14-deGFP) 中,另外添加聚合酶酶,总体系为
4 μL
myTXTL不变。使用deGFP标准曲线将生成的deGFP的特异性荧光信号转换为
deGFP 浓度。结果可知deGFP
的产生非常迅速,仅在孵育2.3 小时后就达到了平台期。在
1 单位 T7
RNA 聚合酶和
2000 pM T7p14-deGFP 质粒处观察到了
0.78 nM 的明显峰值
deGFP。在蛋白质生产中观察到的快速下降可能是由于
T7 RNA 聚合酶活性随时间下降或
T7 RNA 聚合酶储存缓冲液中包含的甘油等成分的不利影响所致。下图中显示的结果表明,在使用无细胞系统时需要进行分析优化。使用Echo
525 纳升移液器,能够准确、精确地传输具有大动态体积范围的多种流体类型,从而实现了这种优化。
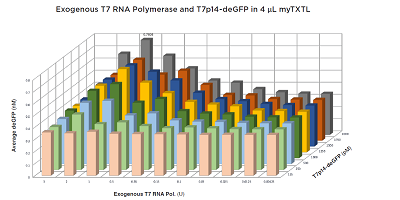
图3:4μL
myTXTL 中,添加外源性T7
RNA 聚合酶和T7p14-deGFP质粒,得到产物dGFP荧光值
本文中,我们展示了 Echo 525 纳升液体移液系统,对 Arbor
Biosciences 的 myTXTL 无细胞表达系统的准确和精确处理。myTXTL
Master Mix 的高通量液体处理允许对数百到数千个基因模板构建体进行分析,并在几个小时内并行研究许多实验条件。同时,使用Echo 525构建高效的体外基因表达系统可减少总反应体积,从而减少试剂成本,同时仍能产生足够的蛋白质用于下游分析和功能测定。与手工操作相比,使用Echo 525上运行的优化实验,不仅结果可靠,还将试剂消耗降低了 3 倍,并节省了许多天的准备时间。
之前我们曾介绍过Echo525在模块化基因元件的组装上的优秀能力,再加上对myTXTL体外蛋白表达系统的亮眼成绩,开创了蛋白质工程的新时代,是合成生物学实验的不二选择。