同学1: 老师,为什么我这次实验PC7通道的目的细胞群上移了?
正常的实验图(PC7通道):
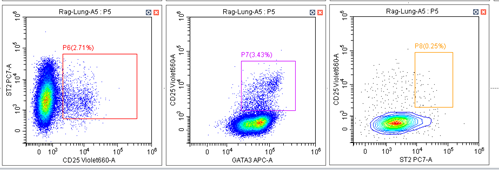
目的细胞群上移的实验图(PC7通道):
小贝: 从这两个对比图可以看出,这次实验PC7通道上的阴性细胞群和阳性细胞群都比正常实验的时候处于坐标轴更高的位置。
同学2: 老师,为什么我这次实验样品的FITC通道的坐标轴变了?
正常的实验图(FITC通道):

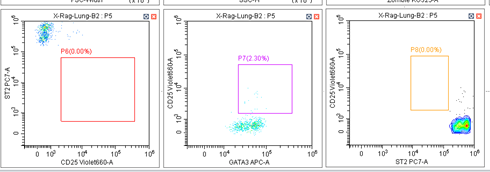
坐标轴改变的实验图(FITC通道):
小贝: 从这两个对比图可以看出,这次实验FITC通道上的阴性细胞群和阳性细胞群都比正常实验的时候处于坐标轴更高的位置。
同学3: 老师,为什么我这次的样品和之前比较,跑偏了?
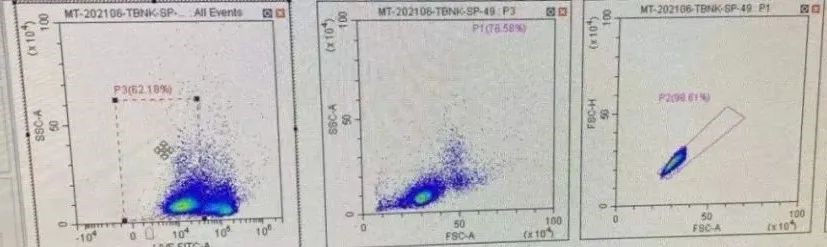
正常的实验图(APC-A750通道):
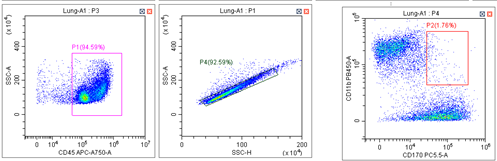
跑偏的实验图(APC-A750通道):
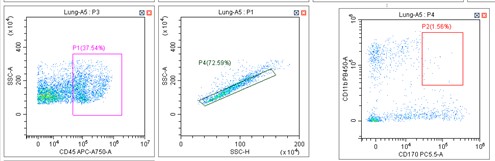
小贝: 从这两个对比图可以看出,这次实验APC-A750通道上的细胞群比正常实验的时候处于坐标轴低的位置。
这三个问题是由不同实验室的同学提出来的,在交流的时候我们都考虑了样品染色、补偿、堵塞等因素,在排除了这些因素之后,我们对仪器进行了细致的清洗,包括含氯清洗液清洗、水洗、深度清洗液清洗、排气泡等,当进行了彻底的清洗后,发现所有的数据就恢复了正常。由此可见,及时清洗,保持管路的清洁,是我们仪器使用的一大基石,是我们数据稳定的保证,在样品量非常大的情况下,或者使用PI等粘性较大的染料时,我们还需要在中途添加清洗的步骤,保证能获取稳定的高质量的数据。
同学1在进行了彻底的清洗后,数据恢复了正常。
和同学2交流时,我们发现数据正常时做仪器QC,FITC通道的增益是146,出现问题的时候是130,当进行了彻底的清洗和排气泡后,FITC增益值回到了之前的数值。这也提示我们,每次做实验前做仪器QC的重要性,如果QC中有通道的增益和以往有差别,要及时进行清洗、排气泡的操作而不是忽视它。
思维发散区:当我们发现数据和之前不一样的时候,可以怎么做呢?
答案:
1、考虑这一批样品和之前样品的染色有什么不一样的地方,比如说细胞的状态,抗体的批次,抗体的浓度等等;
2、考虑这个样品的补偿是否合适;
3、在考虑这些问题的时候,可以彻底清洗仪器,包括每日清洗、深度清洗、排气泡等;
4、在清洗完后,做一次仪器的QC,注意QC报告上的增益值、Mean值、rCV值等。
本次解析仅供参考,不是标准答案,谢谢大家的关注!
案