
RNA提取过程中,在加入氯仿混匀静置3min后,需进行12000g,4℃,离心15min,离心后液体分层,RNA在上层水相中。
在此步骤离心中,需要全程保持低温,防止RNA降解。实验室所用的贝克曼高速冷冻离心机能满足这一条件,并且降温速度足够快,不需提前准备,非常方便。但需要注意一点,设置的离心时间包含了升降速时间,因此需要设置比所需时间长30s左右。
设备名称:微量高速冷冻离心机
设备型号:Microfuge20R
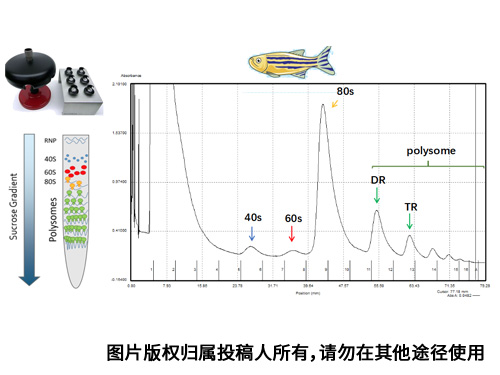
本图是由模式动物斑马鱼的野生型斑马鱼动物整体经过Beckman Optima XE-100离心机SW41Ti转子在40000 rpm下离心2.5h分离得到的核糖体图谱。
实验先采用重量比质量在密度梯度离心机上采用短帽,制作10-50%线性密度。使用1天的斑马鱼经过蛋白裂解液裂解冰上裂解10 min后12000rpm离心15 min,取上清加入制作好的梯度密度蔗糖上进行Beckman超速离心。对斑马鱼这类动物核糖体分离离心,需要特别注意样品的细胞量,以及样品是否需要匀浆过程,如有匀浆不可以太久,否则会破坏核糖体相互作用,影响结果。
这个实验感悟颇多;首先实验图谱呈现优美的幅度,且各个类型的核糖体分离均匀,层次清晰。结果中峰图下方的背景曲线平滑没有杂峰。既可以从中见证核糖体翻译的组装经历过程;核糖体中的多聚体分离逐步减少,像一座座小山,又像人生的阶梯一步步登上高峰。山水风光,见证美丽实验生活。
注:本图尚未发表,严禁投稿论文使用
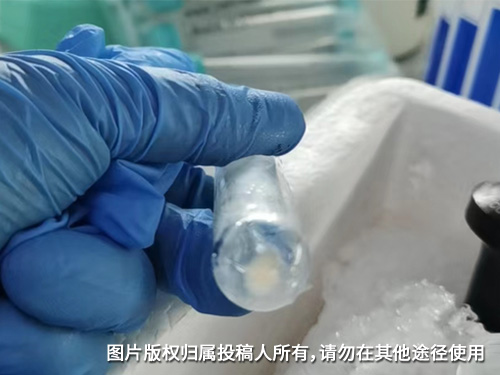
使用Beckman超速离心机Optimal-100XPN,转头型号为SW 32 Ti:6 x 38.5 mL和SW 41 Ti 6 x 13.2mL 提取外泌体,先用SW 32 Ti100000g离心70min,弃去上清,PBS重悬并收集多个离心管中液体转入SW 41Ti再次100000g离心70min,离心管底部淡黄色沉淀为外泌体。超速离心机在操作时一定要注意配平,带上转头称量配平,精确到小数点后3位。

从研究生开始做实验到现在使用Optima L-100XP已经有5年了,设备虽然购置早,但性能相对稳定。我做的是囊泡研究,需要使用该仪器将细胞上清进行超速离心。首先需要将细胞上清进行300-10000 g的梯度离心以去除活细胞、死细胞及细胞碎片。然后转入贝克曼超速离心管中,在Optima L-100XP中以100000 g离心至少70 min,得到的沉淀再用PBS重悬,重新以100000 g离心至少70 min,则所获沉淀即为所需。这里的问题是无论是定角离心还是水平离心,由于囊泡是纳米颗粒,在二次超速离心后得到的沉淀均肉眼不可见,因此对沉淀的位置和范围的准确判断至关重要,特别是针对定角离心,否则囊泡的得率将变得非常低。分享的图片是荧光染料标记的囊泡在超速离心后的离心管底图片,有助于判断沉淀的位置。
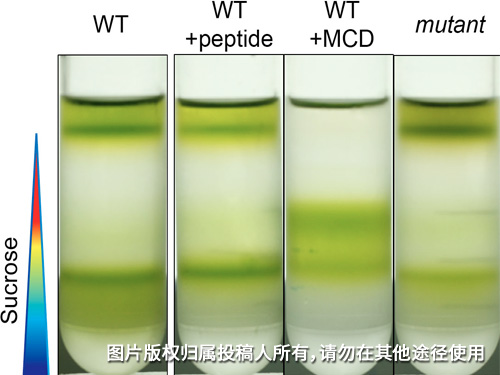
植物体内DRMs粗提方法
取~0.5g植物幼苗(正常生长7 d),在液氮中研磨至粉末,加入1.5 ml NEBT于粉末中,于冰上缓慢解冻,转移至离心管中,冰上放置30-60 min。
在38 mL的聚碳酸酯超速离心管(贝克曼库尔特,SW32Ti转子)中,加入配制的60 %的蔗糖溶液2 mL至离心管管底,在其上方依次铺上2 mL的浓度为55%,50%,45%,40%,35%,30%,25%,20%,15%,10%的蔗糖溶液,注意加入时不要晃动离心管,避免不同浓度的蔗糖分层不明显。冰上放置,待用。
将提取完成后的样品4 °C,16000 g,离心10 min,取上清液约2 mL,置于离心管中22 mL连续蔗糖梯度(10 - 60%)最上层,用万分之一天平对离心管进行配平,质量差值不能大于0.001。然后将离心管放入贝克曼SW32Ti转子中,设置参数为4℃,32000 rpm(约180000 g)离心18小时。DRMs大致位于35%浓度蔗糖处。

我们实验室用的是贝克曼立式高速冷冻离心机,型号是Avanti J-26xp。每次使用离心机之前,我都会提前将离心机的温度和转速设置好进行预冷,一般都是离心菌体和发酵液,分离的效果很好,分离的上清液去做高效液相色谱进行检测分析也很干净,检测不到菌体之类的杂质。我觉得这种离心机的优点是容量很大,离心的效果好,需要的时间短,离心的温度可以调节,而且温度和转速也都实时地显示出来了,转子的数量也可以自己选择,也很安全,不用担心散热的问题。
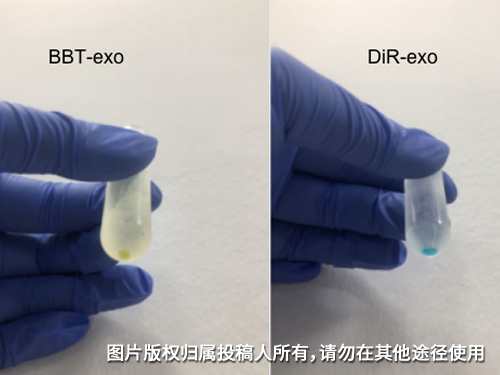
图为合成的NIR二区荧光染色剂BBT及商业染色剂DiR对外泌体的染色效果对比。
使用落地式XPN-100离心机,sw55转头,5ml离心管。在4摄氏度下,12万g(RCF)离心70分钟,去上清,重复两次。
实验中,先用荧光染色剂对已完成提取的4T1细胞外泌体于PBS体系中过夜染色,染色结束后使用PBS将样品稀释至4.5ml左右,离心70分钟后倒去上清,再次使用PBS稀释样品,重复离心步骤,即可达到洗去游离的荧光染色剂的目的。
该步骤中使用的转速和时间与提取外泌体最后一步骤相同,确保外泌体能沉于离心管底部,如图,可以看出染色后的外泌体清晰可见。同时实验也设有对照组,验证了游离的荧光染色剂不会在该转速沉淀。
染色后的外泌体可以用于流式细胞仪、荧光成像、体内成像。
使用离心机需要注意严格配平等问题,在离心机升速过程中要注意调整转速。

在我们提取大肠杆菌核糖体过程中,要经过反复的超速离心。使用的离心机机型是Optima XPN-100 Ultra,整套实验流程下来,大约需要一周时间,其中离心约60小时,主要使用Type 45Ti和SW32 Ti两种离心转子,包括sucrose cushion pellet,sucurose gradient等。每次核糖体纯化出来,都能感觉自己快累得散架,但为了课题、为了科研也得加油呀。
早些时候听着仪器加速、减速的声音,心也不自觉地跟着紧张得要命,就怕转子突然飞出来。还梦见过夜离心时离心管破裂,离心机故障,吓得都没睡好。五年过去,和超速离心机也算是老伙伴了,操作熟练,也不再胆战心惊。每次看到纯化出来漂亮的核糖体图片,不论是蛋白胶图还是负染图片,还是很满足开心哒。

① 利用beckman台式超速离心机Optima MAX-XP,搭配MLA-50转头,361625超离管,120,000×g,65min后得到细胞外囊泡,用2mL PBS重悬后,装载在Beckman超离管底部。上方依次缓慢加入36%、26%、14%和6%w/v的碘克沙醇溶液;
② 利用beckman超速离心机L-100XP,搭配SW32 Ti转头,355631超离管,150,000×g,4h,升3降5,得到八个组分,从上到下依次收集这些组分,分别用1mL PBS重悬;
③ 利用beckman台式超速离心机Optima MAX-XP,搭配MLA-50转头,361625超离管,120,000×g,65min后得到沉淀,分别重悬于50μL PBS中。
④ 利用NTA检测不同组分中样本浓度和粒径,利用TEM检测不同组分中样本形态;
实验结果表明:
① F2,F3,F4中存在非常纯的细胞外囊泡,呈茶托状结果,同时F3中细胞外囊泡数量最多,F2与F4中相差无几;
② F1,F7,F8中几乎没有细胞外囊泡,F5和F6存在细胞外囊泡,但同时存在很多污染物;

我们实验室使用的是贝克曼台式低温离心机。配制不用密度的蔗糖溶液,按由高到低的顺序加之离心管,可看到明显的分层,最后将样本加到最上层,100,000g离心8小时,提取不同密度的中间层,100,000g离心1小时,即可获得目的大小的小纳米分子。

速度和多功能性优势一起融合入紧凑小巧的小型冷冻离心机设备。快速,低温运行且功能齐全的Microfuge 20小型台式冷冻离心机经过精心设计,可以满足实验室各种应用需求,包括:
1、制冷型离心机
2、核酸和蛋白制备
3、制粒,萃取
4、纯化
5、浓缩
6、相分离和受体结合
7、蛋白质沉降、颗粒和细胞碎片快速沉淀
贝克曼台式冷冻离心机,将减速快、噪音低、控温稳定,设备质量性价比高,原厂在国内各大城市均有常驻服务工程师,响应快,售后服务好,是不二选择。

我们实验室一般使用贝克曼低温超速离心机离心脂质体。脂质体经过薄膜分散法制备后,使用PH=7.4的PBS水化至脂质体终浓度为2mg/mL。水化后经超声可获得空白脂质体,或者在此步骤中添加需要包裹的药物,即可获得载药脂质体。待样品制备完成后,根据实验计划选择合适的转子和超速离心管,我一般使用100ti的转子,5mL的超速离心管。本实验脂质体离心设置的程序为30000rpm,4℃离心2h,升速设为max ,降速设为4。在这个条件下是可以将脂质体离心到离心管的底部,最后检测脂质体的包封率。

1.取新鲜动物组织0.1~0.2g置于组织匀浆器中,加入预冷的Trizol液1ml于匀浆器中,在冰浴中迅速匀浆15~30s,以充分研碎组织。然后将细胞悬浮液吸入另一1.5ml管中,于室温下静置5min。
2.加入200 μl氯仿,剧烈振摇15s混匀后,室温静置3min。
3. 4℃,12 000r/min离心15min,RNA分布于水相中。
4.将上层无色水相转移到另一管中,加入500 μl异丙醇,室温静置10min。
5. 4 ℃,12 000r/min离心10min。
6.弃上清液,用1ml 75%乙醇洗涤RNA沉淀物,4 ℃,12000r/min离心5min。
7.弃上清液,室温干燥15min.
8.向干燥过的沉淀物中加入200μl DEPC水溶解沉淀物,于-20 ℃保存备用。

© 2000- 贝克曼库尔特国际贸易(上海)有限公司保留最终解释权


